産生
20世紀20年代中期建立的量子力學很快被運用在化學鍵的研究上。與此同時,一些物理的實驗方法在化學結構的研究中也取得很大進展。例如應用X射線衍射法和電子衍射法已測出某些分子結構中化學鍵的鍵長和鍵角,分子光譜法的使用加深了對分子中電子的分布和其所處能級的了解。這些實驗成果為化學鍵的研究提供了必要的實驗數據。
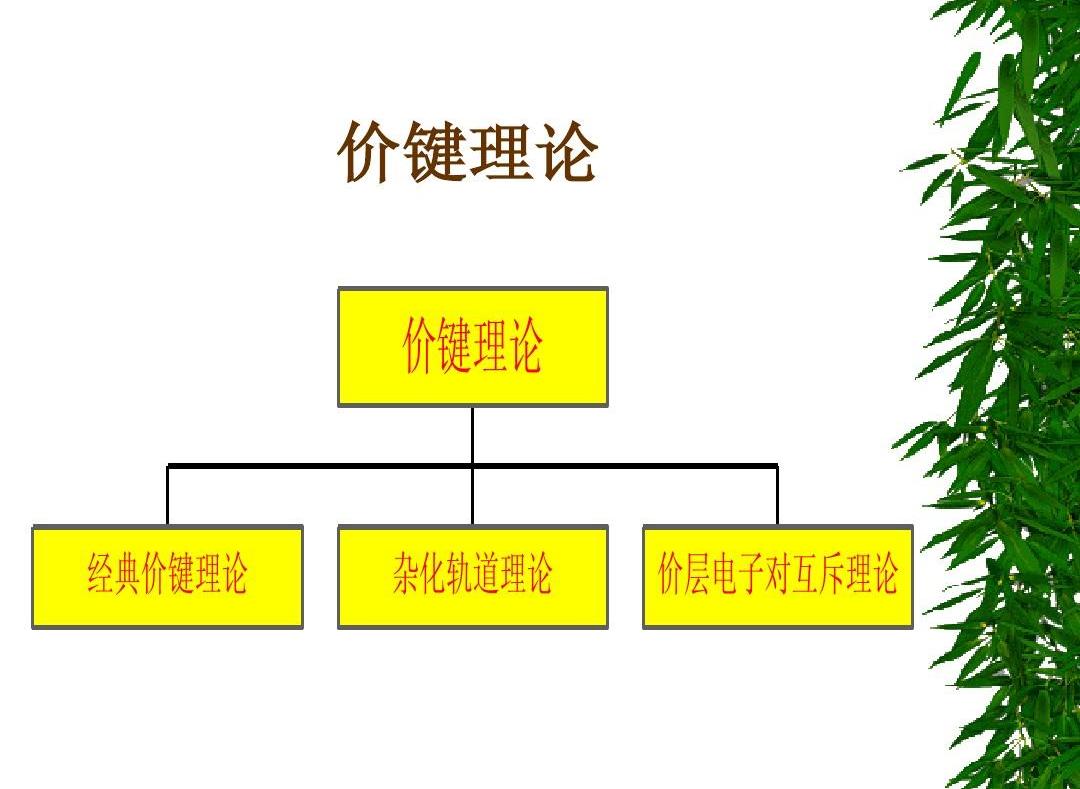
1927年W.H.海特勒和F.W.倫敦首次完成了氫分子中電子對鍵的量子力學近似處理,這是近代價鍵理論的基礎。L.C.鮑林等加以發展,引入雜化軌道概念,綜合成價鍵理論,成功地應用于雙原子分子和多原子分子的結構。
價鍵理論與化學家所熟悉的經典電子對鍵概念相吻合,一出現就得到迅速發展。但價鍵理論計算比較複雜,使得後來發展緩慢。随着計算技術日益提高,該理論還會有新發展。
1927年,Heitler和London用量子力學處理氫氣分子H2,解決了兩個氫原子之間化學鍵的本質問題,使共價鍵理論從典型的Lewis理論發展到今天的現代共價鍵理論。
海特勒-倫敦方法處理氫分子 氫分子的哈密頓算符是:
式中rA1、rB1為核A、B與電子1之間的距離;r12為兩個電子之間的距離;RAB為兩個原子核之間的距離……;1/RAB表示兩個原子核之間的勢能(氫核和電子電荷皆為 1基本電荷單位);1/rA1、1/rB1、…也是勢能;墷是拉普拉斯算符。
海特勒-倫敦方法的要點在于如何恰當地選取基态H2的近似波函數Ψ(1,2)(或稱嘗試波函數),然後用變分公式使氫分子能量E為最低(假定Ψ是歸一化的):
式中*表示複數共轭。考慮兩個氫原子組成的體系,若兩個氫原子A(有電子1)和B(有電子2)的基态波函數為:
φA⑴=πexp(-rA1)
φB⑵=πexp(-rB2)
假如兩個氫原子相距很遠,那麼體系波函數是:
Φ1(1,2)=φA⑴φB⑵
實際上兩個電子是不可區分的。同樣合适的函數是:
Φ2(1,2)=φB⑴φA⑵
兩個函數Φ1和Φ2都對應相同的能量。海特勒和倫敦就取兩個函數的等權線性組合作為H2的變分函數:
Ψ(1,2)=c1Φ1+c2Φ2
解久期方程得c1=±c2,波函數和能量是:
式中
s稱原子軌道的重疊積分。算出能量公式中各項,積分得:
式中Q、J、s都是R的函數。若用ΔE±表示分子能量與兩個分離原子能量之差:
ΔE±就是分子相對于分離原子能量為零時的能量。因為H11和H12都是負量,Ψ+态比Ψ-态能量更低,中ΔE+曲線總處于ΔE-曲線的下面。圖中虛線表示實驗勢能曲線。ΔE+曲線有極小值,表示形成了穩定的 H2。在平衡核間距 Re=0.87埃,計算得到離解能De=3.14電子伏(或稱結合能)。與實驗值Re=0.742埃,De=4.75電子伏略有差異,這反映了海特勒-倫敦法的近似程度。ΔE-在R 減小時一直升高。Ψ+稱海特勒-倫敦函數,描述H2基态,Ψ-描述排斥态。
若考慮自旋,按照泡利原理,必須使分子波函數對電子交換是反對稱的。則Ψ+必須乘以反對稱自旋函數而給出自旋單重态:
Ψ-必須與對稱自旋函數相乘得到自旋三重态:
Ψ+态描述了H2的共價鍵,其中電子自旋是配對的,故稱共價鍵為電子對鍵。
電子密度分布 可以幫助理解共價鍵的本質。從波函數Ψ±出發可以計算總電子密度為兩個單電子幾率密度P±⑴和P±⑵的和乘以電子電量(a,u)。點(x,y,z)處的總電子密度為:
= ⑴
若φA、φB為氫原子的1s軌道,則:
式中rA、rB分别表示從點(x,y,z)到核A和B的距離。總電子電荷密度沿核間軸分布。由ρ+曲線可見,電子電荷從核外區移向兩核之間的區域,相當于電子同時吸引兩核,因而降低了勢能。由式⑴可知,兩原子核愈接近,重疊積分愈大,電荷在核間區愈密集,也即共價鍵愈牢固(最大重疊原則)。但原子核愈接近,核排斥能和電子排斥能也同時增加,所以氫分子有一穩定的平衡核間距。Ψ-态的電子電荷從核間區移向核外區,使得核間屏蔽減少,能量升高,形成排斥态。
電子電荷在兩核間密集,影響分子的平均動能〈T〉和平均勢能〈V〉。為深入理解共價鍵的本質,按雙原子分子的維裡定理計算出2的〈T〉和〈V〉:
又分子總能量E=〈T〉+〈V〉。如已知E 随R 的改變的(dE/dR),則得:
=-【E+R(dE/dR)】
=2E+R(dE/dR)
計算得到的H2基态E、;、〈V〉都是R 的函數。
當核間距減少時,電子同核吸引的平均勢能降低,但電子的排斥能的平均值增加,核的排斥能也增加。核間距達到某一值(1.401a0,a0為玻爾半徑)時,平均總勢能達到極小值,電子将在此勢阱中運動,此時,dE/dR=0,平均動能等于平均總勢能的負值的一半,氫分子的總能量則為勢能平均值的一半。
處理氫分子的方法
價鍵理論是海特勒倫敦處理氫分子方法的推廣,要點如下:①若兩原子軌道互相重疊,兩個軌道上各有一個電子,且電子自旋方向相反,則電子配對給出單重态,形成一個電子對鍵。②兩個電子相互配對後,不能再與第三個電子配對,這就是共價鍵的飽和性。③遵循最大重疊原則,共價鍵沿着原子軌道重疊最大的方向成鍵。共價鍵具有方向性。
原子軌道通常在某個特定方向上有最大值,隻有在此方向上軌道間才有最大重疊而形成共價鍵。不同原子軌道有不同成鍵能力。原子軌道的最大值作為原子軌道成鍵能力的度量,鮑林給出s、p、d、f等原子軌道成鍵能力依次為 1、6、10、14。在主量子數相同時,成鍵能力大的軌道形成的共價鍵較牢固。
氫分子中的化學鍵
量子力學計算表明,兩個具有電子構型的H彼此靠近,兩個1s電子以自旋相反的方式形成電子對,使體系的能量降低。吸熱,即破壞H2的鍵要吸熱(吸收能量),此熱量D的大小與H2 分子中的鍵能有關。計算還表明,若兩個1s電子保持以相同自旋的方式,則r越小,V越大。此時,不形成化學鍵。如圖中上方紅色曲線所示,能量不降低。H2中的化學鍵可以認為是電子自旋相反成對,使體系的能量降低。從電子雲角度考慮,可認為H的1s軌道在兩核間重疊,使電子在兩核間出現的幾率大,形成負電區,兩核吸引核間負電區,使H結合在一起。
相關理論
将對H2的處理結果推廣到其它分子中,形成了以量子力學為基礎的價鍵理論(V.B.法)。
共價鍵的形成
A,B兩原子各有一個成單電子,當 A,B相互接近時,兩電子以自旋相反的方式結成電子對,即兩個電子所在的原子軌道能相互重疊,則體系能量降低,形成化學鍵,亦即一對電子則形成一個共價鍵。
形成的共價鍵越多,則體系能量越低,形成的分子越穩定。因此,各原子中的未成對電子盡可能多地形成共價鍵。配位鍵形成條件:一種原子中有孤對電子,而另一原子中有可與對電子所在軌道相互重疊的空軌道。在配位化合物中,經常見到配位鍵。在形成共價鍵時,單電子也可以由對電子分開而得到。
方向性和飽和性
共價鍵的數目由原子中單電子數決定(包括原有的和激發而生成的. 例如:O有兩個單電子,H有一個單電子,所以結合成水分子,隻能形成2個共價鍵;C最多能與H形成4個共價鍵。原子中單電子數決定了共價鍵的數目。即為共價鍵的飽和性。
各原子軌道在空間分布是固定的,為了滿足軌道的最大重疊,原子間成共價鍵時,當然要具有方向性。共價鍵的鍵型
共價鍵的鍵型分類
成鍵的兩個原子間的連線稱為鍵軸. 按成鍵與鍵軸之間的關系,共價鍵的鍵型主要為兩種:
a)σ 鍵
σ 鍵特點:将成鍵軌道,沿着鍵軸旋轉任意角度,圖形及符号均保持不變. 即鍵軌道對鍵軸呈圓柱型對稱,或鍵軸是n重軸。
b) π鍵
π鍵特點:成鍵軌道圍繞鍵軸旋轉180°時,圖形重合,但符号相反。
π鍵參數:化學鍵的形成情況,完全可由量子力學的計算得出,進行定量描述。但通常用幾個物理量加以描述,這些物理量稱為鍵參數。
a) 鍵能
AB(g) —— A(g) + B(g) H = EAB = DAB
對于雙原子分子,解離能DAB等于鍵能EAB,但對于多原子分子,則要注意解離能與鍵能的區别與聯系。另外,相同的鍵,在不同化合物中,鍵長和鍵能不相等。例如,CH3OH中和C2H6 中均有C-H鍵,而它們的鍵長和鍵能不同。
c) 鍵角
是分子中鍵與鍵之間的夾角(在多原子分子中才涉及鍵角)。
如,H2S分子,H-S-H的鍵角為 92°,決定了H2S分子的構型為“V”字形。
又如:CO2中,O-C-O的鍵角為180°,則CO2分子為直線形。
因而,是決定分子幾何構型的重要因素。
觀點
價鍵理論是量子力學近似處理氫分子結果的推廣,認為成鍵原子彼此靠近時,各自具有的反平行自旋的未成對電子,偶合配對達到電子對共用,使體系能量降低,而形成穩定的共價鍵。所以把價鍵理論也叫電子配對法。n自旋反平行的成對電子的偶合所以能降低體系能量而成鍵,可以看做成鍵原子的原子軌道相互作用的結果。
成鍵原子彼此接近到一定距離時,各自的反平行自旋的未成對電子不僅圍繞自身原子軌道運轉,而且受對方原子核的吸引并繞其原子軌道運轉,這樣相互作用的結果,體系能量下降而鍵合。這是以薛定谔方程近似處理氫分子得到的結論。
一般常把電子對的共用稱為軌道交蓋或電子雲重疊。n價鍵理論認為一個原子如果有幾個未成對電子,就可以與幾個自旋反平行的電子配對成鍵,因而一個原子有幾個未成對電子,其化合價就是幾。同時認為一個電子既與另一個電子配對,就不能再與第三個原子的電子配對,這稱為共價鍵的飽和性。
共價鍵也常常具有方向性,因為除s軌道為球形對稱之外,所有原子軌道都具有一定的取向。而當原子軌道交蓋成鍵時,軌道交蓋越多則形成的共價鍵越牢固,因此共價鍵的形成必然采取可能範圍内交蓋程度最大的方向交蓋成鍵,所以共價鍵有方向性,生成的分子也必然具有一定的立體構型。