QP的作用
目前企业安装QP系统是纸质手册电子化试点的要求,电子化手册项下的报关单必须使用QP系统录入,如果代理报关公司没有安装QP系统,将无法预录入报关单数据。
报关系统
报关单申报系统的主要功能包括:报关单的预录入、申报、打印;转关运输提前报关单的录入、申报、打印;出口二次转关单的预录入、查询、申报;报关单(包括转关运输提前申报的报关单和其随附的转关运输申报单)的查询;报关清单的预录入、申报、查询、打印、下载;海关回执的查询;业务统计等。通过该系统企业可以方便、快捷地进行报关单、转关运输提前运输报关单、转关运输申报单的录入、申报、相关数据查询、海关回执查询、业务统计等,从而有效地提高报关企业的工作效率。
2006年,青岛数据分中心在山东电子口岸平台上部署推广了QUICKPASS报关申报系统,并在全关区所有现场完成了切换,有力支持了“多点报关、口岸验放”改革。期间先后启动了黄岛、大港与其他隶属海关之间,日照与临沂、淄博间的“多点报关,口岸验放”及黄岛、大港之间“互为口岸,两地报关”改革。目前,内陆地区90%以上的进出口企业采用“多点报关”模式通关,最高达98%。企业通关时间由3天缩短到1天,内陆海关报关单量增长了近6倍,分流了口岸海关约15%的报关单量,大大缓解了现场忙闲不均的状况,也极大增强了内陆海关服务地方经济发展的能力。
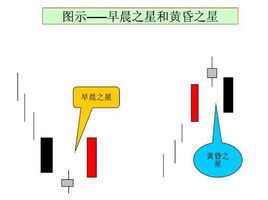
准峰值
检波方式:准峰值
准峰值(QP),所表现的是测量信号能量的大小。由于准峰值检波器的充电时间要比放电时间快得多,因此信号的重复频率越高,得出的准峰值也就越高。(在GB9254-1998中提到过在测量接收机上所示的读数在限值附近波动时,则读数的观察时间应不少于15s,记录最高读数,而孤立的瞬间高值忽略不记。)准峰值检波器还能以线性方式对不同幅度的信号起响应。这样,准峰值既可以反映信号的幅度,也能反映出信号的时间分布。
QP值是一种测量方法
在该测量过程中,随着构成信号的光谱成分的重复出现,信号增多,也就是说QP值的测量结果取决于信号重复出现的频率,根据它们的重复出现频率,信号主要有两种,一种为宽带信号,另一种是窄带信号,窄带信号是一种可以被光谱公析仪所分解的信号,不间断波信号就是一种频率固定不变的窄带信号,宽带信号是一种不能被光谱分析仪分解的信号。
如果是窄带信号,在Peak值,QP值以及平均值的测量中会产生相同的振幅,如果是宽带信号,测量出的QP值就小于Peak值,信号的增加量(可以通过QP值的测量电路中具体的充放电时间常量来解释)是被测信号的重复出现频率的函数信号的重复出现频率越低QP什就越小。由于QP值测量仪会用到充放电时间常量,因此当QP值测量仪接通时,光谱分析仪就必须减慢其扫描的速度,由于信号QP值总是小于或等于其Peak值,所以只有当信号的Peak值接近或超过测试限值时才有必要测量它的QP值。
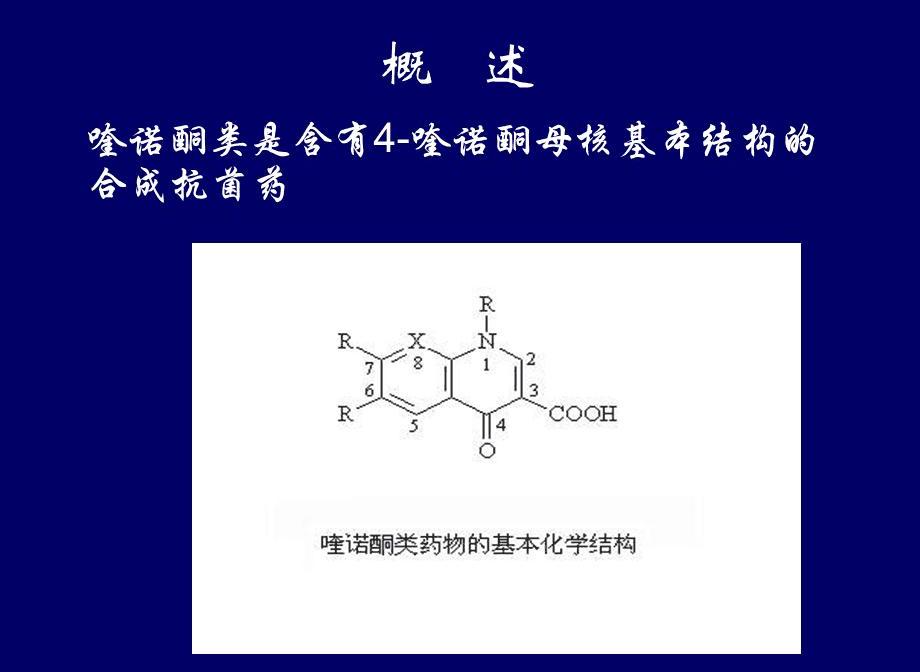
二次规划
二次规划是非线性规划中的一类特殊数学规划问题,在很多方面都有应用,如投资组合、约束最小二乘问题的求解、序列二次规划在非线性优化问题中应用等。在过去的几十年里,二次规划已经成为运筹学、经济数学、管理科学、系统分析和组合优化科学的基本方法。
到目前为止,已经出现了很多求解二次规划问题的算法,如Lemke方法、内点法、有效集法、椭球算法等等,并且现在仍有很多学者在从事这方面的研究工作。
受权人
Qualified Person: 质量受权人
欧盟有关质量受权人的法规自1975 年开始执行,对质量受权人(Qualified Person,QP)的资质、职责有明确要求,而且欧盟GMP 全面引述了相关的规定;WHO关于质量受权人(Authorized Person,AQ)的规定与欧盟基本一致。美国FDA 没有相关规定,但其职责被包含在质量管理部门和质量负责人的职责中。新版中国GMP 引入了质量受权人的概念,并对其职责作出基本规定。药品质量受权人(Qualified Person,简称QP)是指具有相应专业技术资格和工作经验,经企业的法定代表人授权,全面负责药品生产质量的高级专业管理人员。药品质量授权人则是药品生产企业的法人代表,将药品生产质量管理方面的职责全权授予药品质量受权人。1975年,欧盟颁布75/319/EEC 法令,首次写入药品质量受权人制度。欧盟规定每家企业至少应有一位质量受权人,生产的每批药品都要质量受权人签字放行后才能上市销售。
《药品生产质量管理规范》2010修订版
第二十三条关键人员至少应包括企业负责人、生产管理负责人、质量管理负责人和质量受权人。关键人员应为企业的全职人员。
质量管理负责人和生产管理负责人不得互相兼任。质量管理负责人和质量受权人可以兼任。
第二十五条质量受权人
质量受权人承担产品放行的职责,参与质量管理活动。应制定操作规程确保质量受权人独立履行职责,不受企业负责人和其他人员的干扰。