简介
键能通常通过热化学方法或光谱化学实验测定离解能得到,我们常用键能表示某种键的强弱。
注意:键能大小并不能被用于表示物质能量多少,而只表示物质与达到活泼态时自由能之差。
键能与物质本身的关系:键能越大,本身能量就越低,键能越小,本身能量越高。
做为反应物的物质,在反应过程中需要吸热,产生上述原因是因为:能量低,本身结构稳定,需要吸收更多的热量,键能大。能量高,本身结构不稳定,需要吸收的热量低,键能小。
计算方法
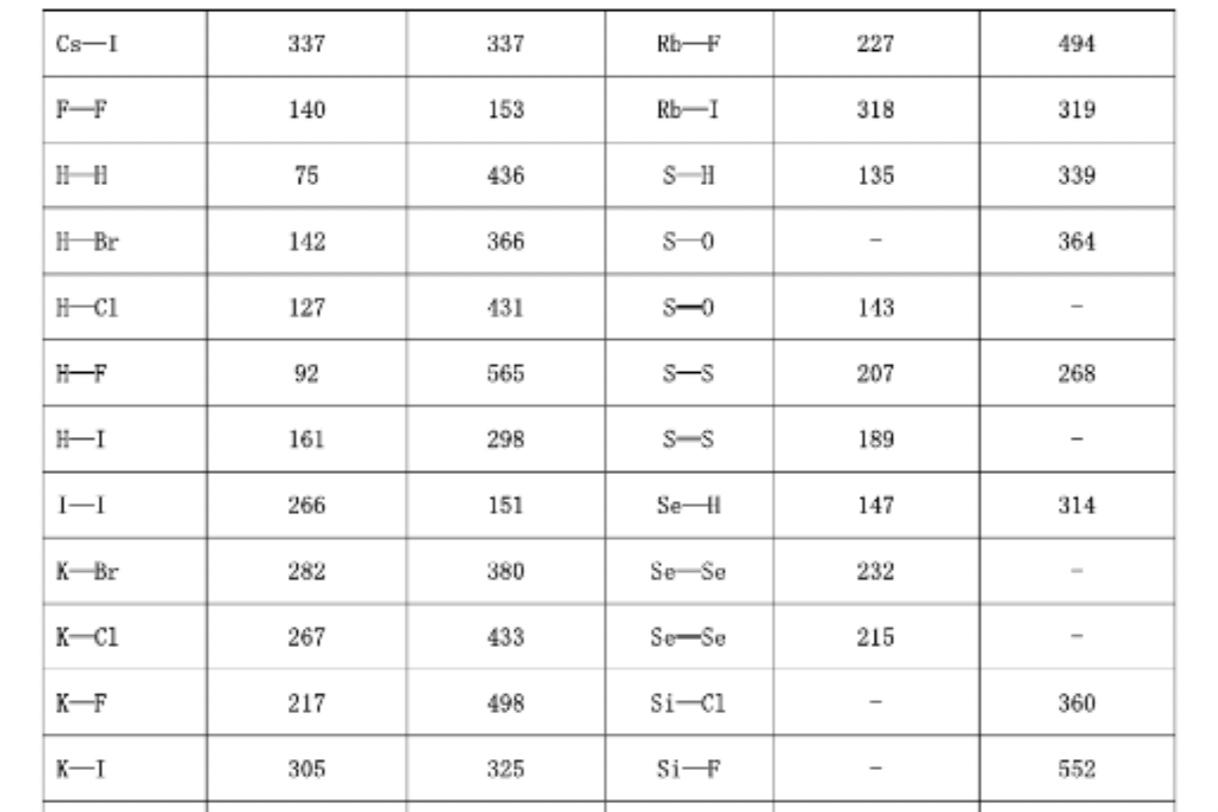
键能是表征化学键强度的物理量,可以用键断裂时所需的能量大小来衡量。
对于双原子分子,键能等于键的解离能,可直接热化学测量中得到。例如:
Cl2(g)→2Cl(g),ΔHm,298.15K(Cl2)=e(Cl2)=D(Cl2)=247kJ.mol-1
在多原子分子中断裂气态分子中的某一个键所需的能量叫做分子中这个键的离解能。例如:
NH3(g)= NH2(g)+ H(g),D1 = 435kJ·mol-1
NH2(g)= NH(g)+ H(g),D2= 397kJ·mol-1
NH(g)= N(g)+ H(g),D3= 339kJ·mol-1
NH3分子中虽然有三个等价的N-H键,但先后拆开它们所需的能量是不同的。所谓键能(Bond Energy)通常是指在101.3KPa和298K下将1mol气态分子拆开成气态原子时,每个键所需能量的平均值,键能用E表示:
E(N-H)=(D1+D2+D3)/3=1171/3=391kJ·mol-1
一般来说键能越大,化学键越牢固。双键的键能比单键的键能大得多,但不等于单键键能的两倍;同样三键键能也不是单键键能的三倍。