簡介
鍵能通常通過熱化學方法或光譜化學實驗測定離解能得到,我們常用鍵能表示某種鍵的強弱。
注意:鍵能大小并不能被用于表示物質能量多少,而隻表示物質與達到活潑态時自由能之差。
鍵能與物質本身的關系:鍵能越大,本身能量就越低,鍵能越小,本身能量越高。
做為反應物的物質,在反應過程中需要吸熱,産生上述原因是因為:能量低,本身結構穩定,需要吸收更多的熱量,鍵能大。能量高,本身結構不穩定,需要吸收的熱量低,鍵能小。
計算方法
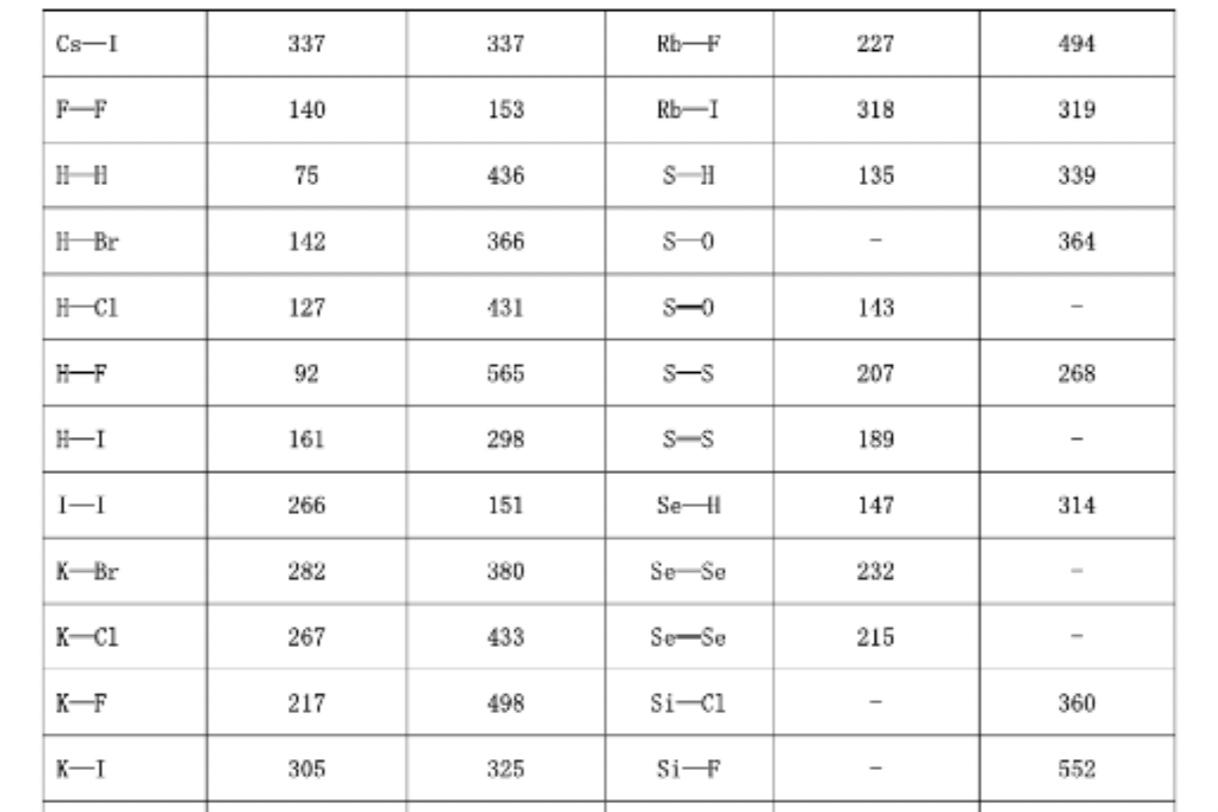
鍵能是表征化學鍵強度的物理量,可以用鍵斷裂時所需的能量大小來衡量。
對于雙原子分子,鍵能等于鍵的解離能,可直接熱化學測量中得到。例如:
Cl2(g)→2Cl(g),ΔHm,298.15K(Cl2)=e(Cl2)=D(Cl2)=247kJ.mol-1
在多原子分子中斷裂氣态分子中的某一個鍵所需的能量叫做分子中這個鍵的離解能。例如:
NH3(g)= NH2(g)+ H(g),D1 = 435kJ·mol-1
NH2(g)= NH(g)+ H(g),D2= 397kJ·mol-1
NH(g)= N(g)+ H(g),D3= 339kJ·mol-1
NH3分子中雖然有三個等價的N-H鍵,但先後拆開它們所需的能量是不同的。所謂鍵能(Bond Energy)通常是指在101.3KPa和298K下将1mol氣态分子拆開成氣态原子時,每個鍵所需能量的平均值,鍵能用E表示:
E(N-H)=(D1+D2+D3)/3=1171/3=391kJ·mol-1
一般來說鍵能越大,化學鍵越牢固。雙鍵的鍵能比單鍵的鍵能大得多,但不等于單鍵鍵能的兩倍;同樣三鍵鍵能也不是單鍵鍵能的三倍。