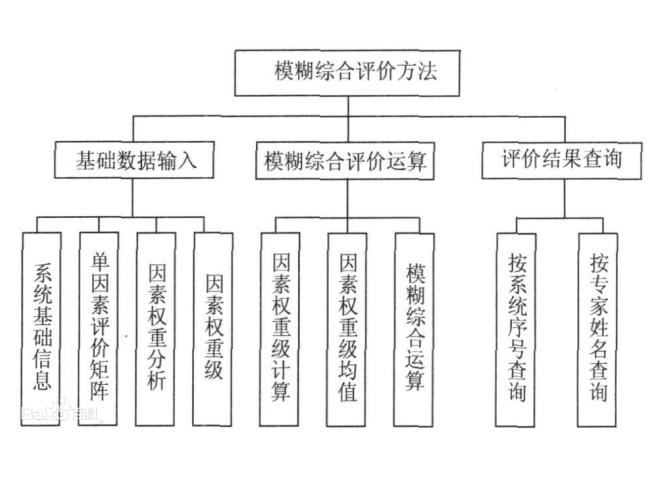
簡介
條件:鹽必須溶于水,鹽必須能電離出弱酸根離子或弱堿陽離子。
實質:(從水的電離平衡下手)鹽溶于水電離出的某種離子,與水電離的氫離子或氫氧根離子結合生成弱電解質,使水的電離平衡發生移動。
規律:難溶不水解,有弱才水解,無弱不水解;誰弱誰水解,越弱越水解,都弱都水解;誰強顯誰性(适用于正鹽),同強顯中性,弱弱具體定;越弱越水解,越熱越水解,越稀越水解。(即鹽的構成中出現弱堿陽離子或弱酸根陰離子,該鹽就會水解;這些離子對應的堿或酸越弱,水解程度越大,溶液的pH變化越大;水解後溶液的酸堿性由構成該鹽離子對應的酸和堿相對強弱決定,酸強顯酸性,堿強顯堿性。)
特點
(1)水解反應和中和反應處于動态平衡,水解進行程度很小。
(2)水解反應為吸熱反應。
(3)鹽類溶解于水,以電離為主,水解為輔。
(4)多元弱酸根離子分步水解,以第一步為主。
(5)鹽類水解的離子反應方程式。
因為鹽類的水解是微弱且可逆的,在書寫其水解離子反應方程式時應注意以下幾點:
(1)應用可逆符号表示。
(2)由于鹽類的水解程度通常很小,因此在書寫水解離子方程式時不标“↓”“↑”,但是如果存在雙水解的情況,通常需要标注“↓”“↑”,且可逆符号要換成等于号。
(3)多元弱酸根的水解分步進行且步步難,以第一步水解為主。
水解平衡的因素
影響水解平衡進行程度最主要因素是鹽本身的性質。
①組成鹽的酸根對應的酸越弱,水解程度越大,堿性就越強,PH越大;
②組成鹽的陽離子對應的堿越弱,水解程度越大,酸性越強,PH越小;
外界條件對平衡移動也有影響,移動方向應符合勒夏特列原理:
①溫度:水解反應為吸熱反應,升溫平衡右移,水解程度增大。
②濃度:改變平衡體系中每一種物質的濃度,都可使平衡移動。鹽的濃度越小,水解程度越大。
③溶液的酸堿度:加入酸或堿能促進或抑制鹽類的水解。例如:水解呈酸性的鹽溶液,若加入堿,就會中和溶液中的H+,使平衡向水解的方向移動而促進水解;若加入酸,則抑制水解。
同種水解相互抑制,不同水解相互促進。
影響因素
影響鹽類水解程度大小的因素
1.内因:即鹽中弱離子與水電離出的H+或OH-結合生成的弱電解質越難電離(電離常數越小),對水的電離平衡的促進作用就越大,鹽的水解程度就越大。
2.外因:
(1)溫度:升溫,促進水解。水解反應是中和反應的逆反應,所以水解反應為吸熱反應。
(2)濃度:
加水,促進水解;但對于水解顯酸性的鹽,酸性下降;對于水解顯堿性的鹽,堿性下降。
加鹽,水解平衡向正向移動,但鹽的水解程度下降,對于水解顯酸性的鹽,溶液的酸性增強,對于水解顯堿性的鹽,溶液的堿性增強。
(3)酸、堿
對于水解顯酸性的鹽,加酸會抑制水解,加堿會促進水解;
對于水解顯堿性的鹽,加堿會抑制水解,加酸會促進水解。
(4)鹽
水解顯酸性的鹽溶液與水解顯堿性的鹽溶液混合,兩種鹽水解互促水解。
均顯酸(堿)性的鹽溶液混合,兩種鹽水解一般互相抑制。