特征
作為報告基因,在遺傳選擇和篩選檢測方面必須具有以下幾個條件:
(1)已被克隆和全序列已測定;
(2)表達産物在受體細胞中本不存在,即無背景,在被轉染的細胞中無相似的内源性表達産物;
(3)其表達産物能進行定量測定。
應用
植物工程
在植物基因工程研究領域,已使用的報告基因有以下幾種:胭脂堿合成酶基因(nos)、章魚堿合成酶基因(ocs)、新黴素磷酸轉移酶基因(nptⅡ)、氯黴素乙酰轉移酶基因(cat)、慶大黴素轉移酶基因、葡萄糖苷酶基因、熒光酶基因等。nos、ocs這兩個基因是緻瘤土壤農杆菌(Agrobacterium tumfaciens)的Ti質粒特有的,對Ti質粒進行改造,用相應的緻瘤農杆菌轉化植物體時,如果外源基因轉入植物體中,則這兩種報告基因在植物根莖葉中均能表達,不受發育調控,檢測時直接用轉化體提取液進行紙電泳,染色後在紫外光下觀察熒光即可。nptⅡ、cat及慶大黴素轉移酶基因,均為抗生素篩選基因,相關的酶可以對底物進行修飾(磷酸化、乙酰化等),從而使這些抗生素失去對植物生長的抑制作用,使得含有這些抗性基因的轉化體能在含這些抗生素的篩選培養基上正常生長,也可以用轉化體提取液體,外用同位素标記,放射自顯影篩選轉化體。常用的一種報告基因是β-D-葡萄糖苷酶基因,該酶催化底物形成β-D-葡萄糖苷酸,它在植物體中幾乎無背景,組織化學檢測很穩定,可用分光光譜、熒光等進行檢測。熒光酶基因(luc)是1985年從北美熒火蟲和叩頭蟲cDNA文庫中克隆出來的,該酶在有ATP、Mg2+、O2和熒光素存在下發出熒光,這樣就可用轉基因植物整株或部分直接用X-光片或專門儀器進行檢測。
動物工程
在動物基因表達調控的研究中,報告基因也被廣泛應用。常用的有氯黴素乙酰轉移酶基因(cat)、β-半乳糖苷酶基因(LacZ)、二氫葉酸還原酶基因、熒光酶基因等。cat基因作為報告基因,檢測時可通過放射自顯影觀察。熒光酶基因作為報告基因,具有檢測速度快、靈敏度比cat基因高30~1000倍、費用低、不需使用放射性同位素等優點,得到了廣泛的采用。
檢測因子作用
可通過報告基因的表達,研究蛋白質與蛋白質之間的相互作用。雙雜交體系是由報告基因轉錄調控區、報告基因及一對可以相互作用的雜合反式作用因子組成。來從上述雜交體系中發展出的單一雜交體系技術,也是根據報告基因表達量的檢測篩選出與已知順式作用元件相結合的未知因子的DNA,該項技術正廣泛應用于克隆細胞中含量微弱且用生化手段難以純化的反式作用因子。
由此可知,報告基因在基因表達調控和基因工程研究中處于非常重要的地位,它是作為外源目的基因能否轉化植物體的探路先鋒而首先被研究的,在研究植物的基因表達調控方面起着重要的作用,現已推廣到真核生物的基因調控領域中。随着基因工程技術日新月異的發展,報告基因這一探路者的作用會更明顯。
列舉
(1)最常用的報告基因大多是編碼抗生素抗性蛋白的基因,通過檢查産物是否具有抗生素的抗性來确定基因的表達情況。
(2)氯黴素乙酰基轉移酶(CAT):該報告基因來源于大腸杆菌轉位子9,是第1個用于檢測細胞内轉錄活性的報告基因。氯黴素乙酰基轉移酶可催化乙酰CoA的乙酰基轉移到氯黴素3羟基,而使氯黴素解毒。CAT在哺乳細胞無内源性表達,性質穩定,半衰期較短,适于瞬時表達研究。可用同位素、熒光素和酶聯免疫吸附測定(enzyme—linkedimmunosorbantassay,ELISA)檢測其活性,也可進行蛋白質印迹(Westernblotting)和免疫組織化學分析。CAT與其他報告基因相比,線性範圍較窄,靈敏性較低。
(3)β半乳糖苷酶:β半乳糖苷酶由大腸杆菌lacZ基因編碼,可催化半乳糖苷水解。最大優勢是易于用免疫組織化學法觀測其原位表達,是最常用的監測轉染率的報道基因之一。以鄰—硝基苯—β—D—半乳吡喃糖苷(ONPG)為底物可用标準的比色法檢測酶活性,其檢測動力學範圍為6個數量級。氯酚紅—β—D—半乳吡喃糖苷(CPRG)是另一個可用比色法檢測酶活性的底物,其靈敏度比ONPG高近10倍。以MUG和熒光素二半乳糖苷(FDG)為底物則可用熒光法檢測其活性。此法可檢測單個細胞的酶活性,并可用于流式細胞學(FACS)分析。如以二氧雜環丁烷為底物,可用化學發光法檢測酶活性,其檢測動力學範圍最大,靈敏度最高,與用生物發光法檢測熒光素酶活性的靈敏度相似。
(4)熒光素酶:熒光素酶是能夠催化不同底物氧化發光的一類酶,哺乳細胞無内源性熒光素酶。最常用的熒光素酶有細菌熒光素酶、螢火蟲熒光素酶和Renilla熒光素酶。細菌熒光素酶對熱敏感,因此在哺乳細胞的應用中受到限制。螢火蟲熒光素酶靈敏度高,檢測線性範圍寬達7~8個數量級,是最常用于哺乳細胞的報道基因,用熒光比色計即可檢測酶活性,因而适用于高通量篩選。随着具有膜通透性和光裂解作用的螢火蟲熒光素酶的應用,無需裂解細胞即可檢測酶活性。
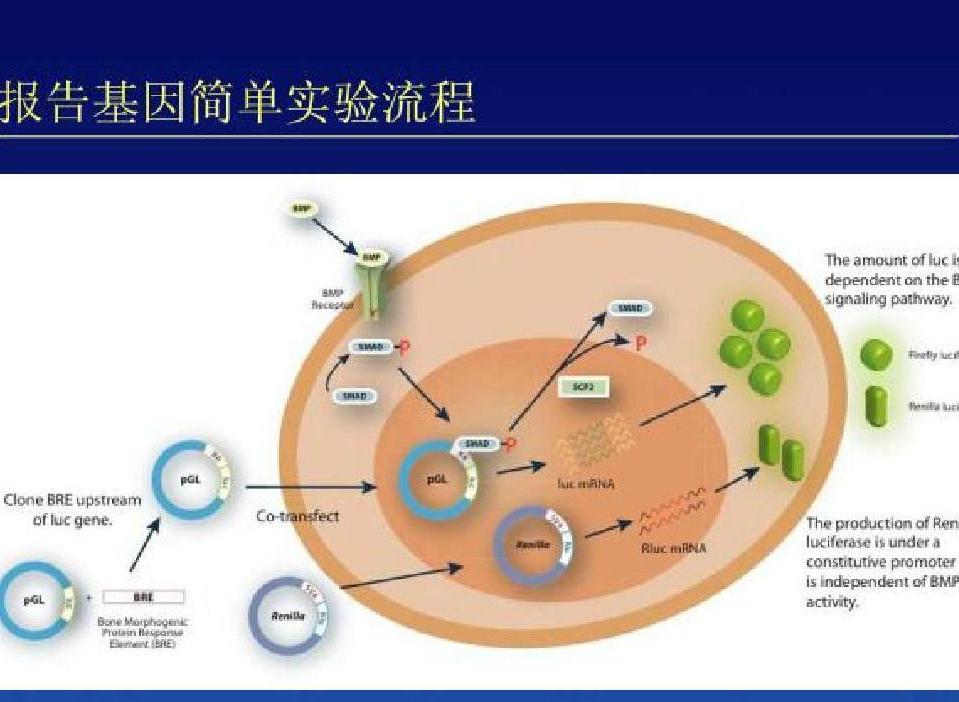
Renilla熒光素酶催化腸腔素(coelenterazine)氧化,産物可透過生物膜,可能是最适用于活細胞的報告分子。将熒光素酶報告基因載體轉染到細胞中,可用熒光素酶檢測系統靈敏方便地測定熒光素酶基因的表達。自1986年起,螢火蟲熒光素酶基因被用作測定基因表達的報告基因,獲得了廣泛的應用。Promega公司的pGL3及pGL2系列載體,含SV40啟動子及增強子的不同組合,有助于分析DNA片段的轉錄活性。
熒光素酶報告基因有許多優點:①非放射性;②比CAT及其他報告基因速度快;③比CAT靈敏100倍;④熒光素酶在哺乳細胞中的半衰期為3小時,在植物中的半衰期為3.5小時。由于半衰期短,故啟動子的改變會即時導緻熒光素酶活性的改變,而熒光素酶不會積累。相反,CAT在哺乳細胞中的半衰期為50小時。熒光素酶濃度在10—16mol/L(10pS/L)到10-8mol/L(1mg/L)範圍内,熒光信号強度與酶濃度成正比。在理想條件下,可檢測到l0-20mol/L的熒光素酶。Promega公司的熒光素酶檢測系統比一般的方法靈敏及簡單,産生的光穩定。
(5)分泌型堿性磷酸酶(SEAP):SEAP是人胎盤堿性磷酸酶的突變體,無内源性表達。SEAP缺乏胎盤堿性磷酸酶羧基末端的24個氨基酸。其優點是無需裂解細胞,隻用培養介質即可檢測酶活性,便于進行時效反應試驗。以間硝基苯磷酸鹽(PNPP)為底物時可用标準的比色法測定酶活性,操作簡單,反應時間短,價格廉價,但靈敏度低。以黃素腺嘌呤二核苷酸磷酸為底物進行比色測定,其靈敏度增高。SEAP可催化D—熒光素—O—磷酸鹽水解生成D—熒光素,後者又可作為熒光素酶的底物,此即兩步生物發光法檢測酶活性的原理。此方法靈敏度高,接近于熒光素酶報告基因的檢測。還可用一步化學發光法檢測酶活性。