研究簡史
1747年,德國化學家馬格拉夫(S·Marggraf)在柏林首次分離出葡萄糖,并于1749年将這一過程發表在《從德國産的幾種植物中提煉蔗糖的化學試驗》一文内,第90頁中寫道:”用少量的水潤濕葡萄幹将其軟化,然後壓榨被擠出的汁,經過提純濃縮後,得到了一種糖。馬格拉夫發現的這種糖就是葡萄糖。
然而,葡萄糖直到1838年才被命名,它的英文名glucose源自于法語的glucose,它是由法國教授尤金-梅爾後佩利戈(Eugène-Melchior Péligot)(1811-1890)首次創造,源自德語中的gleukos——未發酵的甜果酒,前綴gluc-源于德語glykys,即甘甜的意思,後綴-ose則表明其化學分類,指出它是一個碳水化合物。
同年,路易斯·賈奎斯·泰納爾(Louis JacquesThénard)、約瑟夫·路易·蓋-呂薩克(Joseph Louis Gay-Lussac)、讓-巴蒂斯特·畢奧(Jean-Baptiste Biot)和讓-巴蒂斯特·安德烈·杜馬(Jean Baptiste AndreDumas)四位法國科學家聯名發表一篇對于後佩利戈先生的學術論文集的綜述,其名為《對于自然和糖的化學性質的研究》,其109頁中寫道:“那些來源自葡萄、澱粉、蜂蜜甚至導緻糖尿病的物質具有相同的構成和屬性,将這種單一物質命名為葡萄糖。
由于葡萄糖在生物體中的重要地位,了解其化學組成和結構成為19世紀有機化學的重要課題。1884年,埃米爾·費歇爾(Fischer)開始研究糖類。當時所知的單糖隻有4種:兩種己醛糖(葡萄糖、半乳糖)、兩種己酮糖(果糖 、山梨糖),它們具有相同的分子式C6H12O6,慕尼黑大學的化學家吉連尼 ( H.iKhani ) 初步探明葡萄糖和半乳糖是直鍊的五羟基醛,果糖和山梨糖是直鍊的五羟基酮。
費歇爾發現,葡萄糖、果糖和甘露糖與苯臍生成相同的脈,因此推斷,這三種糖在第二個碳原子以下具有相同的構型。根據範特霍夫(Van’t Hoff)和勒貝爾(eLeBl)的立體異構理論,費歇爾推斷,己醛糖有16種可能的構型,用氧化、還原、降解、加成等方法,到1891年,他确定了D-己醛糖所有成員的構型。1892年德國化學家費歇爾确定了葡萄糖的鍊狀結構及其立體異構體,并由于其在立體化學的巨大成就,獲得1902年諾貝爾化學獎。
2022年4月,中國科學家通過電催化結合生物合成的方式,将二氧化碳高效還原合成高濃度乙酸,進一步利用微生物可以合成葡萄糖和油脂。這一成果由電子科技大學、中國科學院深圳先進技術研究院與中國科學技術大學共同完成, 2022年4月28日以封面文章形式在國際學術期刊《自然—催化》發表。
理化性質
葡萄糖(Glucose)無色結晶或白色結晶性或顆粒性粉末;無臭,味甜,有吸濕性,易溶于水。
⒈旋光性
α-D-葡萄糖在20℃時的比旋光度數值為+52.2°。
⒉溶解度
在20℃時單一的葡萄糖溶液最高濃度為50%。
⒊甜度
α-D-葡萄糖的比甜度為0.7。
⒋黏度
葡萄糖的黏度随着溫度的升高而增大。
密度:1.581g/cm3
熔點:146ºC
沸點:527.1ºC at 760 mmHg
閃點:286.7ºC
折射率: 1.362
儲存條件:2-8ºC
化學性質
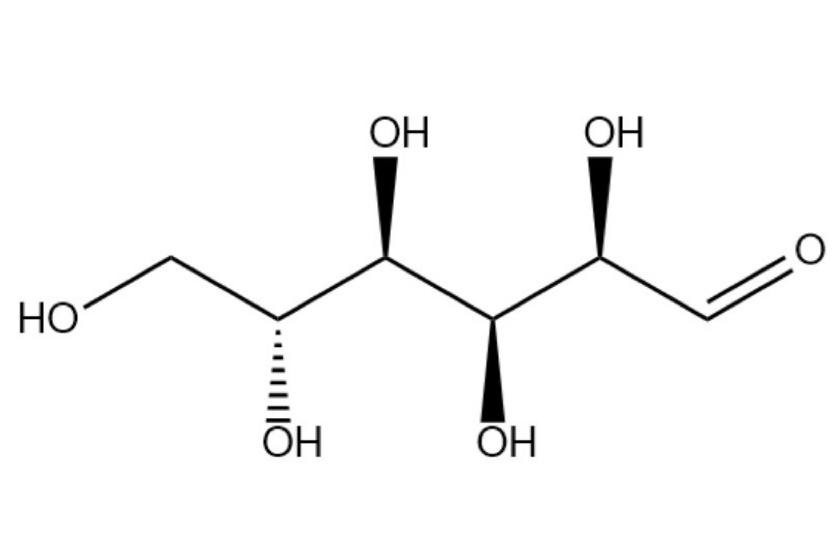
它是自然界分布最廣泛的單糖。葡萄糖含五個羟基,一個醛基,具有多元醇和醛的性質。
在堿性條件下加熱易分解。應密閉保存。口服後迅速吸收,進入人體後被組織利用。1mol葡萄糖經人體完全氧化反應後放出2870kJ能量,這些能量有部分能量轉化為30或32 mol ATP,其餘能量以熱能形式散出從而維持人體體溫,也可通過肝髒或肌肉轉化成糖原或脂肪貯存。
(1)分子中的醛基,有還原性,能與銀氨溶液反應,被氧化成葡萄糖酸铵。
(2)醛基還能被還原為己六醇。
(3)分子中有多個羟基,能與酸發生酯化反應。
(4)葡萄糖在生物體内發生氧化反應,放出熱量。
(5)葡萄糖能用澱粉在酶或硫酸的催化作用下水解反應制得。
(6)植物光合作用。
(7)葡萄糖與新制氫氧化銅反應。
(8)葡萄糖在一定條件下分解成為水和二氧化碳。
(9)麥芽糖的水解。
(10)澱粉和纖維素水解。
制備方法
1.由食用玉米澱粉用食品級酸和/或酶部分水解後所得的糖類水溶液,經淨化、濃縮而成。由于水解程度的不同,所含D-葡萄糖的量,可相差很大。由玉米澱粉制得者,示稱“玉米糖漿”。
2.葡萄糖可以澱粉為原料,經鹽酸或稀硫酸水解制得。也可以澱粉為原料在澱粉糖化酶的作用下而制得。
化合物簡介
安全信息
危險類别碼:R36/37/38
安全說明:S36/37/39-S26
異構體
同分異構體
阿洛酮糖(psicose,allulose);果糖(fructose);山梨糖(sorbose);塔格酮糖(tagalose);肌醇(inositol)
手性異構體
阿洛糖(allose);阿卓糖(altrose);甘露糖(mannose);古洛糖(gluose);艾杜糖(idose);半乳糖(galactose);塔羅糖(talose)
旋光異構體
貯藏
在幹燥的條件下,葡萄糖具有良好的穩定性,水溶液可經高壓滅菌。過熱可導緻溶液pH值的下降和焦糖化。
散裝成品應在幹燥、低溫密閉容器中貯藏。
驗證醛基
葡萄糖驗證:
⒈葡萄糖溶液與新制氫氧化銅懸濁液反應生成磚紅色沉澱。(濃度高時生成黃色沉澱)
注意事項:⑴ 新制Cu(OH)2懸濁液要随用随配、不可久置。
⑵ 配制新制Cu(OH)2懸濁液時,所用NaOH溶液必須過量。
⑶ 反應液必須直接加熱至沸騰。
⑷ 葡萄糖分子中雖然含有醛基,但是d-葡萄糖中不含有醛基。
⒉葡萄糖溶液與銀氨溶液反應有銀鏡反應
注意事項:⑴ 試管内壁必須潔淨;
⑵ 銀氨溶液随用随配不可久置;
⑶ 水浴加熱,不可用酒精燈直接加熱;
⑷ 可加入氫氧化鈉,以促進反應進行;
⑸ 銀鏡可用稀HNO3浸泡洗滌除去。
加熱還原生成的銀附着在試管壁上,形成銀鏡,所以,這個反應也叫銀鏡反應。
生理生化
中樞神經系統幾乎全部依賴血糖的供應作為能源,一旦血糖上升到80毫克%時可能出現糖尿現象。
工業上葡萄糖由澱粉水解制得,60年代應用微生物酶法生産葡萄糖。這是一項重大革新,比酸水解法有明顯的優點。在生産中原料不必精制,不需耐酸、耐壓的設備,而且糖液無苦味,産糖率高。
葡萄糖在醫學上主要用作注射用營養劑(葡萄糖注射液)。
食品工業上葡萄糖經異構酶處理後可制造果糖,尤其是含果糖42%的果葡糖漿,其甜度同蔗糖,已成為當前制糖工業的重要産品。
葡萄糖是生物體内新陳代謝不可缺少的營養物質。它的氧化反應放出的熱量是人類生命活動所需能量的重要來源。在食品、醫藥工業上可直接使用,在印染制革工業中作還原劑,在制鏡工業和熱水瓶膽鍍銀工藝中常用葡萄糖作還原劑。工業上還大量用葡萄糖為原料合成維生素C(抗壞血酸)。
代謝功能
葡萄糖很容易被吸收進入血液中,因此醫院人員、運動愛好者以及平常人們常常使用它當作強而有力的快速能量補充。
葡萄糖加強記憶,刺激鈣質吸收和增加細胞間的溝通。但是太多會提高胰島素的濃度,導緻肥胖和糖尿病;太少會造成低血糖症或者更糟,胰島素休克(糖尿病昏迷)。葡萄糖對腦部功能很重要,葡萄糖的新陳代謝會受下列因素幹擾:憂郁、躁郁、厭食和貪食。阿爾茲海默症病人紀錄到比其他腦部功能異常更低的葡萄糖濃度,因而造成中風或其他的血管疾病。研究員發現在飲食補充75克的葡萄糖會增加記憶測驗的成績。
葡萄糖被吸收到肝細胞中,會減少肝糖的分泌,導緻肌肉和脂肪細胞增加葡萄糖的吸收力。過多的血液葡萄糖會在肝髒和脂肪組織中轉換成脂肪酸和甘油三酸脂。
适應症
葡萄糖臨床應用廣泛,用于各種高熱、脫水、昏迷或不能進食的患者所需的水分和熱量。體内丢失大量體液時,如吐瀉、大失血等可先靜脈滴注5%~10%葡萄糖和生理鹽水以補充水、鹽和糖分,并用于低血糖、藥物毒物中毒者。靜脈滴注25%~50%的高滲溶液,因其高滲壓作用,可使組織脫水和短暫利尿,與甘露醇聯合交替應用治療腦水腫、肺水腫及降低眼壓。靜脈滴注高滲葡萄糖治療血糖過低。與胰島素合用,因可促進鉀轉移入細胞内,也是高鉀血症治療措施之一。
分解途徑
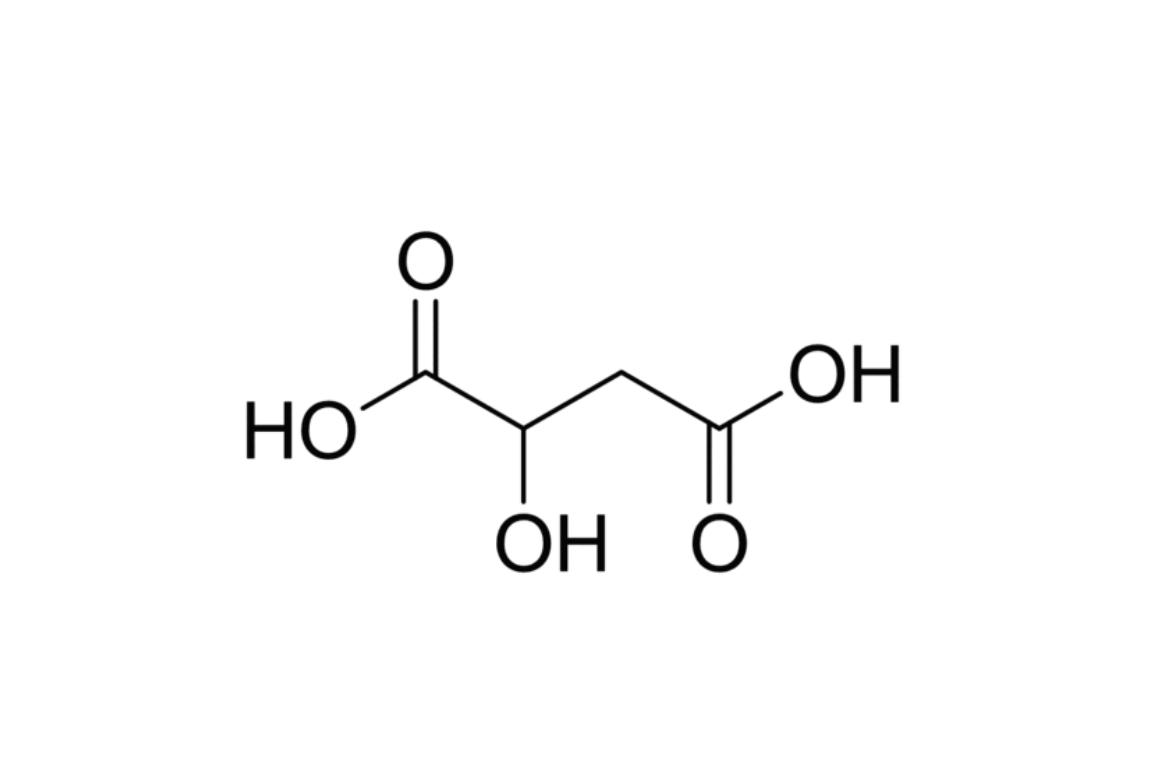
天然的葡萄糖,無論是遊離的或是結合的,均屬D構型,在水溶液中主要以吡喃式構形含氧環存在,為α和β兩種構型的衡态混合物。在常溫條件下,可以α-D-葡萄糖的水合物(含1個水分子)形式從過飽和的水溶液中析出晶體,熔點為80℃;而在50~115℃之間析出的晶體則為無水α-D-葡萄糖,熔點146℃。115℃以上析出的穩定形式則為β-D-葡萄糖,熔點為148~150℃。呋喃環形式的葡萄糖僅以結合狀态存在于少數天然化合物中。
D-葡萄糖具有一般醛糖的化學性質:在氧化劑作用下,生成葡萄糖酸,葡萄糖二酸或葡萄糖醛酸;在還原劑作用下,生成山梨醇;在弱堿作用下,葡萄糖可與另兩種結構相近的六碳糖──果糖和甘露糖──三者之間通過烯醇式相互轉化。葡萄糖還可與苯肼結合,生成葡萄糖脎,後者在結晶形狀和熔點方面都與其他糖脎不同,可作為鑒定葡萄糖的手段。
大多數生物具有酶系統可分解D-葡萄糖以取得能量的能力。在活細胞中,例如哺乳動物的肌肉細胞或單細胞的酵母細胞中,葡萄糖先後經過不需氧的糖酵解途徑、需氧的三羧酸循環以及生物氧化過程生成二氧化碳和水,釋放出較多的能量,以ATP(三磷酸腺苷)形式貯存起來,供生長、運動等生命活動之需。在無氧的情況下,葡萄糖僅僅被分解生成乳酸或乙醇,釋放出的能量少得多,釀酒是無氧分解的過程。工業上,用酸或酶水解澱粉制得的葡萄糖可用做食品、制酒、制藥等工業生産的原料。
藥典标準
《中國藥典》2015版二部1268頁
本品為D-(+)-吡喃葡萄糖一水合物。
【性狀】本品為無色結晶或白色結晶性或顆粒性粉末;無臭,味甜。
本品在水中易溶,在乙醇中微溶。
比旋度 取本品約10g,精密稱定,置100mL量瓶中,加水适量與氨試液0.2mL,溶解後,用水稀釋至刻度,搖勻,放置10分鐘,在25℃時,依法測定(通則 0621),比旋度為+52.6°至+53.2°。
【鑒别】(1)取本品約0.2g,加水5ml溶解後,緩緩滴入微溫的堿性酒石酸銅試液中,即生成氧化亞銅的紅色沉澱。
(2)取幹燥失重項下的本品适量,依法測定,本品的紅外光吸收圖譜應與對照的圖譜(光譜集 702圖)一緻。
【檢查】酸度 取本品2.0g,加水20ml溶解後,加酚酞指示液3滴與氫氧化鈉滴定液(0.02mol/L)0.20mL,應顯粉紅色。
溶液的澄清度與顔色 取本品5.0g,加熱水溶解後,放冷,用水稀釋至10mL,溶液應澄清無色;如顯渾濁,與1号濁度标準液(通則 0902第一法)比較,不得更濃;如顯色,與對照液(取比色用氯化钴液3.0mL、比色用重鉻酸鉀液3.0mL與比色用硫酸銅液6.0mL,加水稀釋成50mL)1.0mL加水稀釋至10mL比較,不得更深。
乙醇溶液的澄清度 取本品1.0g,加乙醇20mL,置水浴上加熱回流約40分鐘,溶液應澄清。
氯化物 取本品0.60g,依法檢查(通則 0801),與标準氯化鈉溶液6.0mL制成的對照液比較,不得更濃(0.01%)。
硫酸鹽 取本品2.0g,依法檢查(通則 0802),與标準硫酸鉀溶液2.0mL制成的對照液比較,不得更濃(0.01%)。
亞硫酸鹽與可溶性澱粉 取本品1.0g,加水10mL溶解後,加碘試液1滴,應即顯黃色。
幹燥失重 取本品,在105℃幹燥至恒重,減失重量為7.5%~9.5%(通則 0831)。
熾灼殘渣 不得過0.1%(通則 0841)。
蛋白質 取本品1.0g,加水10mL溶解後,加磺基水楊酸溶液(1→5)3mL,不得發生沉澱。
鋇鹽 取本品2.0g,加水20mL溶解後,溶液分成兩等份,一份中加稀硫酸1mL,另一份中加水1mL,搖勻,放置15分鐘,兩液均應澄清。
鈣鹽 取本品1.0g,加水10mL溶解後,加氨試液1mL與草酸铵試液5mL,搖勻,放置1小時,如發生渾濁,與标準鈣溶液[精密稱取碳酸鈣0.1250g,置500mL量瓶中,加水5mL與鹽酸0.5mL使溶解,用水稀釋至刻度,搖勻。每1mL相當于0.1mg的鈣(Ca)] 1.0mL制成的對照液比較,不得更濃(0.01%)。
鐵鹽 取本品2.0g,加水20mL溶解後,加硝酸3滴,緩慢煮沸5分鐘,放冷,用水稀釋制成45mL,加硫氰酸铵溶液(30→100)3.0mL,搖勻,如顯色,與标準鐵溶液2.0mL用同一方法制成的對照液比較,不得更深(0.001%)。
重金屬 取本品4.0g,加水23mL溶解後,加醋酸鹽緩沖液(pH 3.5)2mL,依法檢查(通則 0821第一法),含重金屬不得過百萬分之五。
砷鹽 取本品2.0g,加水5mL溶解後,加稀硫酸5mL與溴化鉀溴試液0.5mL,置水浴上加熱約20分鐘,使保持稍過量的溴存在,必要時,再補加溴化鉀溴試液适量,并随時補充蒸散的水分,放冷,加鹽酸5mL與水适量使成28mL,依法檢查(通則 0822第一法),應符合規定(0.0001%)。
微生物限度 取本品10g,用pH 7.0無菌氯化鈉-蛋白胨緩沖液制成1:10的供試液。
需氧菌總數、黴菌和酵母菌總數 取供試液1mL,依法檢查(通則 1105平皿法),1g供試品中需氧菌總數不得過1000cfu,黴菌和酵母菌總數不得過100cfu。
大腸埃希菌 取1:10的供試液10mL,依法檢查(通則 1106),1g供試品中不得檢出。
【類别】營養藥。
【貯藏】密封保存。
【制劑】(1)葡萄糖注射液 (2)葡萄糖粉劑 (3)葡萄糖氯化鈉注射液 (4)複方乳酸鈉葡萄糖注射液
藥物說明
耐量試驗
臨床上做糖尿病的診斷試驗時,通常是測定靜脈空腹血糖。當靜脈空腹血糖<5.0mmol/L,可排除糖尿病;當靜脈空腹血糖>7.0mmol/L并且有臨床症狀時,則可以診斷為糖尿病;而當靜脈空腹血糖在5.5~7.0mmol/L之間并且懷疑糖尿病時,就應該進一步做葡萄糖耐量試驗——OGTT。OGTT試驗是一種口服葡萄糖負荷試驗,用以了解人體對進食葡萄糖後的血糖調節能力。通過OGTT試驗,可以早期發現糖代謝異常,早期診斷糖尿病。
葡萄糖耐量
葡萄糖糖耐量是指機體對血糖濃度的調節能力。正常人在進食米、面主食或服葡萄糖後,幾乎全被腸道吸收,使血糖升高,刺激胰島素分泌、肝糖元合成增加,分解受抑制,肝糖輸出減少,體内組織對葡萄糖利用增加,因此飯後最高血糖不超過10.0mmol/L,且進食或多或少血糖都保持在一個比較穩定的範圍内。這說明正常人對葡萄糖有很強的耐受能力,即葡萄糖耐量正常。但若胰島素分泌不足的人,口服 75g葡萄糖後2小時可超過7.8mmol/L,可等于或大于11.1mmol/L,說明此人對葡萄糖耐量已降低。
葡萄糖耐量檢測
通過葡萄糖耐量實驗來檢測。
方法:口服一定量葡萄糖後,每間隔一定時間測定血糖,利用這一試驗可了解胰島β細胞功能和機體對糖的調節能力。
受檢者口服一定量的葡萄糖後,定時測定血中葡萄糖含量,服後若血糖略有升高,兩小時内恢複服前濃度為正常;若服後血糖濃度急劇升高,2--3小時内不能恢複服前濃度則為異常。臨床上常對症狀不明顯的病人采用該實驗來診斷有無糖代謝異常。
WHO标準化的OGTT:
WHO推薦成人75g葡萄糖,孕婦100g,兒童每公斤體重1.75g,總量≤75g用250ml水溶解,5分鐘内口服。服糖前抽空腹血,服糖後每隔30分鐘取血,共四次。采血同時每隔1小時留尿測尿糖。根據各次血糖水平繪制糖耐量曲線。
試驗前三天每日食物中糖含量應不低于150 g,維持正常活動,影響試驗的藥物應在三天前停用。整個試驗期間不可吸煙、喝咖啡、喝茶或進食。
适用症狀:
①無糖尿病症狀,随機或空腹血糖異常者;
②無糖尿病症狀,有一過性或持續性糖尿;
③無糖尿病症狀,但有明顯糖尿病家族史;
④有糖尿病症狀,但随機或空腹血糖不夠診斷标準;
⑤妊娠期、甲狀腺功能亢進、肝病、感染,出現糖尿者;
⑥分娩巨大胎兒的婦女或有巨大胎兒史的個體;
⑦不明原因的腎病或視網膜病。
劑型
針劑:每支(瓶)5%(250mL,500mL),10%(500mL),25%(20mL),50%(20mL);2.注射劑(粉):250g,500g。
藥理作用
可概括為營養、解毒、強心、利尿,它是生理性糖類,也是機體所需能量的主要來源。它在體内被氧化成二氧化化碳和水并同時提供熱量,以糖原形式貯存。對肝髒具有保護作用和解毒功能,并能促進毒物的排洩。
藥代動力學
口服吸收迅速,進入人體被組織利用,正常人利用葡萄糖能力為6mg/kg。
禁忌症
低滲性脫水患者禁用。
注意事項
1.有低鉀傾向、糖尿病、尿崩症、腎功能不全患者慎用。
2.在使用高濃度糖液過程中,突然停用時,可能引起低血糖。
3.周圍靜脈滴注高滲葡萄糖易發生靜脈炎和血栓,滲漏血管外可刺激局部組織。
4.葡萄糖有吸濕性,且易發黴,故在注射劑的配置和使用過程中,應嚴格按無菌操作。
5.冬季應先将其加熱至與體溫相近,再徐徐靜注,以避免引起血管痙攣。
不良反應
(1)胃腸道反應,如惡心、嘔吐等,見于口服濃度過高過快時。
(2)反應性低血糖。
用法用量
用量視病情而定。
普通口服
葡萄糖在人體新陳代謝中起着重要作用,因此美國藥典載有葡萄糖酸鈣針劑、片劑、葡萄糖酸鉀、葡萄糖酸鐵等并在美國大量生産。在食品加工業非常發達的日本,食品添加劑證書上明确記載葡萄糖酸、葡萄糖酸-δ-内酯、葡萄糖酸鋅、葡萄糖酸鈣、葡萄糖酸亞鐵、葡萄糖酸銅可作為食品添加劑,以葡萄糖為原料深加工,除可制造結晶的葡萄糖酸、葡萄糖酸-δ-内酯外,還可制造各種鹽,如鉀、鈉、鈣、鎂、鋅、鐵、銅等人體必須的微量元素,人體缺少它,就會發生疾病,如缺鐵就會引起貧血,因鐵是血紅蛋白和肌紅蛋白的組織部分,參與氧化和輸送二氧化碳,過去硫酸亞鐵治療貧血,人體雖能吸收,但刺激胃腸,會引起一系列不良反應,故改用葡萄糖酸亞鐵後,胃腸無明顯反應,補鐵效果良好,鑒于這種情況,國家規定,用葡萄糖酸的鉀、鈉、鈣、鋅、銅、鐵、錳等作為人體營養強化劑及藥用補充劑,此類藥品均有很好的治療效果。
長期的、科學合理的服用,對一個民族身體素質的提高是不言而喻的,據日本一資料統計,二戰後日本青少年的平均身高增長了14.8cm,這與他們在食品、藥品制造中科學合理的使用葡萄糖酸微量元素是密不可分的。在中國,大家熟知的葡萄糖酸鈣的針劑、片劑和葡萄糖酸鋅口服液都具有重要的生理功能、治療功能,“巨能鈣”“補鐵口服液”熱銷全國就是一個充分的驗證。
兒童服用
小兒正常生長發育的營養素,以糖、蛋白質及脂肪三大要素為最重要。糖類(碳水化合物)是供應體内熱量的主要來源。葡萄糖是一種單糖,進入體内可被直接利用。1~6個月的嬰兒,食物中的糖類主要是乳糖和少許澱粉。4個月後含澱粉食物逐漸增加,到1歲時胃腸道消化澱粉的各種酶系統逐漸完善,能迅速将其水解為葡萄糖,并在小腸吸收進入血液。吸收後可直接供給能量,或以糖原形式貯存,過量的可變成脂肪。
人體平時不進食葡萄糖,體内也不會缺乏葡萄糖,因此,平時不需補充。但當小兒在患病、拒食時,體質極度衰弱,為保證小兒基礎代謝熱量的需要,短時喂以葡萄糖,是可取的,有時靜脈輸給葡萄糖,就是這個道理。但認為葡萄糖營養價值高,過多過久的給予喂哺,而忽略其他食品供給,可影響小兒食欲,并且由于蛋白質及其它營養素得不到補充,會導緻生長遲緩,嚴重反複感染、營養不良等。還會因血糖升高,引起一過性糖尿,而發生口渴、多飲多尿症狀。
小兒消化道産生其他消化酶的腺體被廢棄不用,長久會導緻萎縮,消化功能更加下降,使之更不能進食其他類食物。正常小兒應盡量讓其多吃澱粉類食物,練習咀嚼,以促進唾液腺的分泌,增強食欲及消化功能,并有利于颌面骨及牙齒的發育。
藥物相互作用
(尚不明确)
注意事項
⑴靜注高滲葡萄糖注射液時應注意藥液有無漏出血管外,以免引起靜脈炎,在同一部位連續注射5%-10%濃度的藥液時也可發生同一并發症。
⑵治療腦水腫使用高滲溶液時如突然停藥,容易發生反跳現象并緻使腦水腫再度發生,故不可突然停藥,而應緩緩減量直至停用。
⑶不宜做皮下注射,以免引起皮下壞死。
⑷顱内或脊髓膜内出血以及脫水病人谵妄時,均禁止使用高滲葡萄糖注射液,以免發生意外。
專家點評
高滲葡萄糖、鉀和胰島素(每提供1000大卡熱量的葡萄糖需鉀30~40mmol)。從營養學角度,對應激狀态下的危重病人需要的熱能部分應由脂肪乳劑提供并同時供給複合氨基酸制劑。
應用領域
(一)發酵工業
微生物的生長需要合适的碳氮比,葡萄糖作為微生物的碳源,是發酵培養基的主料,如抗生素、味精、維生素、氨基酸、有機酸、酶制劑等都需大量使用葡萄糖,同時也可用作微生物多聚糖和有機溶劑的原料。
(二)食品工業
目前結晶葡萄糖主要用于食品行業,随着生活水平的提高和食品行業科技的不斷發展,葡萄糖在食品行業的應用越來越廣泛,今後很長一段時間内食品行業仍是最大的市場。
(三)化學工業
葡萄糖在工業上的應用也很廣,在印染制革工業中作還原劑,在制鏡工業、熱水瓶膽鍍銀及玻璃纖維鍍銀等化學鍍銀工業也常用葡萄糖作還原劑。
葡萄糖在制革工業鉻鞣劑制造中的應用:鉻鞣劑是制造輕革(鞋面革、服裝革)的最好的鞣劑。用鉻鹽制革已有 100年的曆史。所制皮革具有收縮溫度高、彈性好、耐撓曲、耐水洗、堅實耐用等特點。鉻鞣劑主要是堿式硫酸鉻(也可用堿式氯化鉻,但其鞣劑效果較硫酸鉻差)。其制造方法是以葡萄糖或二氧化硫為還原劑,在硫酸溶液中将重鉻酸鹽還原成堿式硫酸鉻,即制成鉻鞣液,鞣液經濃縮、幹燥後,可得到粉狀鉻鞣劑。
(四)合成和轉化
葡萄糖可氫化、氧化、異構、堿性降解、酯化、乙縮醛化反應等,合成或轉化為其他産品。如氫化制山梨醇;氧化制葡萄糖醛酸、二酸等,并可進一步制成酸鈣、酸鈉、酸鋅以及葡萄糖酸δ内酯;異構化為F42、F55、F90果葡糖漿和結晶果糖;也可異構化為甘露糖(生産甘露糖醇原料),其中山梨醇可進一步生成維生素C,被廣泛應用于臨床治療,而且甘露醇15%在臨床作為一種安全有效的降低顱内壓藥物,來治療腦水腫和青光眼。